हाइड्रोजन परमाणु के लिए ऊर्जा-स्तर आरेख निम्नांकित चित्र में प्रदर्शित है-
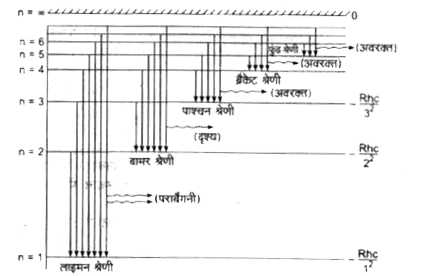
1. लाइमन श्रेणी-जब हाइड्रोजन परमाणु किसी ऊँचे ऊर्जा-स्तर से निम्नतम ऊर्जा-स्तर में आता है (अर्थात् `n_(1)=1` तथा `n_(2)= 2, 3, 4, .....)` तो उत्सर्जित स्पेक्ट्रम की रेखाएँ विकिरण के पराबैंगनी भाग में प्राप्त होती है। इस श्रेणी की रेखाओं की तरंगदैर्घ्यं निम्नलिखित सूत्र से ज्ञात की जा सकती है-
`(1)/(lambda)=R[(1)/(1^(2))-(1)/(n^(2))]" " ["जहाँ" n=2, 3, 4, ...]` (n= 2 के लिए) इस श्रेणी की सबसे बड़ी तरंगदैर्घ्य 1216Å है तथा (`n=oo` के लिए) सबसे छोटी तरंगदैर्घ्य 912Å प्राप्त होती है। लाइमन श्रेणी की प्रथम रेखा की तरंगदैर्घ्य-
`(1)/(lambda)=R[(1)/(1^(2))-(1)/(n^(2))]=R[(1)/(1^(2))=(1)/(2^(2))]=(3R)/(4)`
`lambda=(4)/(3R)=(4)/(3xx1.097xx10^(7))=1216Å`
2 बामर श्रेणी-जब हाइड्रोजन परमाणु किसी ऊँचे ऊर्जा स्तर से दूसरे ऊर्जा-स्तर में आता है अर्थात् `(n_(1)=2` तथा `n_(2) = 3, 4, 5, .....)` तो उत्सर्जित स्पेक्ट्रम की रेखाएँ दृश्य भाग में प्राप्त होती है। इस श्रेणी की रेखाओं की तरंगदैर्घ्य निम्नलिखित सूत्र से ज्ञात की जा सकती है-
`(1)/(lambda)=R[(1)/(2^(2))-(1)/(n^(2))]" " ["जहाँ" n=3,4,5,.....]` n=3 के लिए इस श्रेणी की सबसे बड़ी तरंगदैर्घ्य `lambda= 6563 Å` तथा `n=oo` के लिए इस श्रेणी की सबसे छोटी तरंगदैर्घ्य `lambda = 3646Å` प्राप्त होती है। इस समीकरण में x = 3 रखने पर `H_(a),a= 4` रखने पर `H_(beta)` तथा n=5 रखने पर `H_(gamma)` रेखा की तरंगदैर्घ्य प्राप्त हो जाती है।
3 पाश्चन श्रेणी- जब हाइड्रोजन परमाणु किसी ऊँचे ऊर्जा-स्तर से तीसरे ऊर्जा-स्तर में आता है (अर्थात् `n_(1)=3` तथा `n_(2)=4,5,...)` तो उत्सर्जित स्पेक्ट्रम की रेखाएँ अवरक्त भाग में प्राप्त होती हैं। इस श्रेणी की रेखाओं की तरंगदैर्घ्य निम्नलिखित सूत्र से ज्ञात की जा सकती है-
`(1)/(lambda)=R[(4)/(3^(2))-(1)/(n^(2))]" " [जहाँ n=4, 5, 6,...]` n=4 के लिए इस श्रेणी की सबसे बड़ी तरंगदैर्घ्य `18735 Å` तथा `n=oo` के लिए इस श्रेणी की सबसे छोटी तरंगदैर्घ्य 8196A प्राप्त होती है |
4. बैकेट श्रेणी-जब हाइड्रोजन परमाणु किसी ऊँचे ऊर्जा-स्तर से चौथे ऊर्जा-स्तर में आता है (अर्थात् `n_(1) = 4` तथा `n_(2) = 5,6, 7, .....)` तो उत्सर्जित स्पेक्ट्रम की रेखाएँ अवरक्त भाग में प्राप्त होती हैं। इस श्रेणी की रेखाओं की तरंगदैर्घ्य निम्नलिखित सूत्र से ज्ञात की जा सकती है-
`(1)/(lambda)=R[(1)/(4^(2))-(1)/(n^(2))]" " [जहाँ n=5,6,7,...] = 5` के लिए इस श्रेणी की सबसे बड़ी तरंगदैर्घ्य 40500 तथा `n=oo`के लिए इस श्रेणी की सबसे छोटी तरंगदैर्घ्य 1451Å प्राप्त होती है।
5. कुंड श्रेणी-जब हाइड्रोजन परमाणु किसी ऊँचे ऊर्जा-स्तर से पांचवें ऊर्जा-स्तर में आता है (अर्थात् `n_(1)= 5` तथा `n_(2) = 6, 7, 8, ....)` तो उत्सर्जित स्पेक्ट्रम की रेखाएँ अवरक्त भाग में प्राप्त होती है। इस श्रेणी की रेखाओं की तरंगदैर्घ्य निम्नलिखित सूत्र से ज्ञात की जा सकती है- `(1)/(lambda)=R[(1)/(5^(2))-(1)/(n^(2))] " "[ "जहाँ" n=6,7,8 ...]` n=6 के लिए इस श्रेणी की सबसे बड़ी तरंगदैर्घ्य 74580 Å तथा `n = oo` के लिए इस श्रेणी की सबसे छोटी तरंगदैर्घ्य 22789Å वें प्राप्त होती है।
आयनन ऊर्जा-सामान्यत: हाइड्रोजन परमाणु प्रथम ऊर्जा-स्तर में रहता है, जहाँ उसकी ऊर्जा `E_(1)=(Rhc)/(1^(2))=-Rhc` होती है।
आयनित अवस्था में परमाणु की ऊर्जा `E_(oo)=(Rhc)/(oo)^(2)=0` (शून्य)
अत: हाइड्रोजन परमाणु की आयनन ऊर्जा = आयनन के बाद ऊर्जा `(E_(oo))` -आयनन से पहले ऊर्जा `(E_(1))`
`DeltaE=0-E_(1)=0-(Rhc)=Rhc`
`=1.097xxx10^(7)xx(6.63xx10^(-34))xx(3xx10^(8))`
`=21.8xx10^(-19)` जूल
`=(21.8xx10^(-19))/(1.6xx10^(-19))eV=13.6eV`
लाइमन श्रेणी के लिए, `(1)/(lambda)=R[(1)/(1^(2))-(1)/(2^(2))]`
`=(3R)/(4) rArr lambda=(4)/(3R)`
ऊर्जा `E=(hc)/(lambda)=(hc)/(4//3R)=(3)/(4)Rhc`
`=(3)/(4)xx13.6=10.2eV`
बामर श्रेणी के लिए, `(1)/(lambda)=R[(1)/(2^(2))-(1)/(3^(2))]`
`=(5R)/(36) rArr lambda=(36)/(5R)`
ऊर्जा `E=(hc)/(hc)/(36//5R)=(5)/(36)Rhc`
`=(5)/(36)xx13.6=1.89eV`
