अष्टफलकीय संकरों के निर्माण की व्याख्या VBT किस प्रकार करती है?
अष्टफलकीय संकरों के निर्माण की व्याख्या VBT किस प्रकार करती है?
लिखित उत्तर
Verified by Experts
संयोजकता आबन्ध सिद्धान्त (Valence Bond Theory)
यह सिद्धान्त पोलिंग ने सन् 1931 ई० में दिया था। यह संकुल यौगिकों में केन्द्रीय धातु आयन की सामान्य अवस्था में इलेक्ट्रॉनिक संरचना, आबन्ध, ज्यामिति तथा चुम्बकीय गुणों के विषय में जानकारी देता है। संयोजी आबन्ध सिद्धान्त की मुख्य अभिधारणाएँ अनलिखित हैं -
(i) संकुल यौगिकों में केन्द्रीय धातु परमाणु या आयन के पास उचित लिगण्डों के साथ उपसहसंयोजन आबन्ध बनाने के लिए आवश्यकतानुसार खाली कक्षक होते हैं। ये खाली कक्षक केन्द्रीय धातु परमाणु या आयन की उपसहसंयोजन संख्या के बराबर होते हैं।
(ii) केन्द्रीय धातु परमाणु या आयन के ये खाली कक्षक (s, p या d) संकरित होकर समान संख्या में समान ऊर्जा के नए संकरित कक्षक देते हैं। इन संकरित कक्षकों की निश्चित ज्यामिति होती है। संकुल यौगिकों के निर्माण में निम्नलिखित प्रकार के संकरण होते हैं -

(iii) केन्द्रीय धातु परमाणु या आयन के संकरण में भाग लेने वाले.d-कक्षक अन्दर के अर्थात् (n-1)d या बाह्यतम nd कक्षक हो सकते हैं। उदाहरणार्थ-अष्टफलकीय संकरण में भाग लेने वाले कक्षक दो 3d,एक 4s तथा तीन 4p `(d^(2)sp^(3))` अथवा एक 4s, तीन 4p तथा दो 4d `(sp^(3)d^(2))` हो सकते हैं।
(iv) अन्दर वाले d-कक्षकों का प्रयोग करने वाले संकुल यौगिकों में अयुग्मित इलेक्ट्रॉनों की संख्या कम होती है। इन्हें भीतरी कक्षक निम्न चक्रण या चक्रण युग्मित जटिल यौगिक कहते हैं।
प्रबल लिगेण्ड - `NCS^(-) lt Py lt NH_(3)lt e n lt "bipy" lt NO_(2)^(-) lt CN^(-)lt CO`
बाह्य -कक्षकों का प्रयोग करने वाले संकुल यौगिकों में अयुग्मित इलेक्ट्रॉनों की संख्या अधिक होती है। इन्हें बाह्य कक्षक, उच्च चक्रण या चक्रण मुक्त संकुल यौगिक कहते हैं।
दुर्बल लिगेण्ड- `I^(-) lt Br^(-) lt Cl^(-) lt NO_(3)^(-) lt F^(-) lt OH^(-) lt C_(2)H_(5)OH lt C_(2)O_(4)^(2-)lt H_(2)O`
(v) प्रत्येक लिगेण्ड के पास कम-से-कम एक कक्षक होता है जिसके पास एकाकी इलेक्ट्रॉन युग्म होता है।
(vi) लिगेण्डों के केन्द्रीय धातु परमाणु या आयन के निकट आने पर केन्द्रीय धातु परमाणु या आयन के रिक्त संकरित कक्षक लिगेण्ड के भरे हुए कक्षकों के साथ अतिव्यापन करके लिगण्ड व धातु के बीच उपसहसंयोजन आबन्ध बनाते हैं। इन आबन्धों की संख्या केन्द्रीय धातुं परमाणु या आयन के द्वारा उपलब्ध खाली कक्षकों की संख्या पर निर्भर करती है।
(vii) केन्द्रीय धातु परमाणु या आयन के अन्दर वाले कक्षकों में उपस्थित इलेक्ट्रॉन आबन्ध बनाने में भाग नहीं लेते।
(viii) यदि.संकुल यौगिक में एक या अधिक अयुग्मित इलेक्ट्रॉन होते हैं तो यह अनुचुम्बकीय तथा यदि सभी इलेक्ट्रॉन युग्मित होते हैं तो यह प्रतिचुम्बकीय होता है।
(ix) संकुल यौगिकों के निर्माण में हुण्ड के अधिकतम बहुलता नियम का पालन होता है। हुण्ड के नियम के विपरीत इलेक्ट्रॉनों का युग्मन तभी होता है, जबकि लिगेण्ड प्रबल हो।
1. अष्टफलकीय संकुल यौगिकों में धातु लिगेण्ड आबन्ध
(Metal-Legand Bonding in Octahedral Complex Compounds)
ये संकुल यौगिक `d^(2)sp^(3)` या `sp^(3)d^(2)`-संकरण द्वारा प्राप्त होते हैं। `d_(x^(2)-y^(2))` तथा `d_(z^(2))` कक्षक क्योंकि लिगेण्ड के मार्ग में सीधे आते हैं। अतः ये कक्षक इन संकुल यौगिकों के बनने में प्रयुक्त होते हैं। कुछ अष्टफलकीय संकुल यौगिकों के बनने, संरचना, आकार तथा चुम्बकीय गुणों की विवेचना अनलिखित हैं
(i) हेक्साऐम्मीन कोबाल्ट (II) आयन, `[Co(NH_(3))_(6)]^(3+)` - इस जटिल आयन में कोबाल्ट, `Co^(3+)` आयन के रूप में उपस्थित है जिसका इलेक्ट्रॉनिक विन्यास निम्नलिखित है -
`""_(27)Co=1s^(2), 2s^(2) 2p^(6), 3s^(2) 3d^(7), 4s^(2)`
`Co^(3+) = 1s^(2), 2s^(2)2p^(6), 3s^(2) 3p^(6) 3d^(6)`
`Co^(3+)` आयन में
जब छह `NH_(3)` के अणु `Co^(3+)` आयन के साथ क्रिया करके `[Co(NH_(3))_(6)]^(3+)` संकुल आयन बनाते हैं तो प्रबल लिगेण्ड `NH_(3)` के द्वारा `Co^(3+)` आयन के इलेक्ट्रॉन हुण्ड के नियम के विपरीत युग्मित हो जाते हैं तथा संकरण के छह खाली कक्षक `(d^(2)sp^(3))` उपलब्ध होते हैं, परिणामस्वरूप `Co^(3+)` आयन में `d^(2)sp^(3)` संकरण होता है, जिससे `[Co(NH_(3))_(6)]^(3+)` संकुल आयन के बनने के लिए समान ऊर्जा के छह संकरित कक्षक प्राप्त होते हैं -

अन्दर के d-कक्षकों के बन्ध बनाने में प्रयुक्त होने के कारण इसे भीतरी कक्षक संकुल यौगिक कहते हैं। अयुग्मित इलेक्ट्रॉन न होने के कारण यह प्रतिचुम्बकीय है।
`[Co(NO_(2))_(6)]^(3-), [Co(CN)_(6)]^(3-)`- संकुल आयनों की संरचनाएँ `[Co(NH_(3))_(6)]^(3+)` आयन जैसी होती हैं।
(ii) हेक्साऐक्यो आयरन (II) आयन, `[Fe(H_(2)O)_(6)]^(2+)` - इस संकुल आयन में आयरन, `Fe^(2+)` के रूप में उपस्थित है जिसका इलेक्ट्रॉनिक विन्यास निम्नलिखित है -
`""_(26)Fe=1s^(2), 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(6), 4s^(2)`
`Fe^(2+) =1s^(2) , 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(6)`

जब छह जल के अणु `Fe^(2+)` आयन के साथ क्रिया करके `[Fe(H_(2)O)_(6)]^(2+)` संकुल आयन बनाते हैं तो इलेक्ट्रॉन युग्मित नहीं होते क्योंकि `H_(2)O` एक दुर्बल लिगेण्ड है। अत: 3d-कक्षकों में से कोई भी कक्षक संकरण के लिए उपलब्ध नहीं होता। इस स्थिति में दो खाली 4d-कक्षक संकरण में भाग लेते हैं, परिणामस्वरूप `Fe^(2+)` आयन में `sp^(3)d^(2)` - संकरण होता है जिससे `[Fe(H_(2)O)_(6)]^(2+)` आयन के बनने के लिए समान ऊर्जा के छह संकरित कक्षक प्राप्त होते हैं -
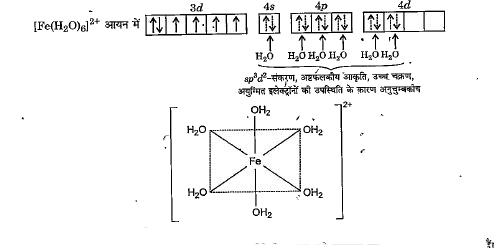
बाह्यतम कोश के d-कक्षकों के आबन्ध बनाने में प्रयुक्त होने के कारण इसे बाह्यतम कक्षक संकुल यौगिक कहते हैं। अयुग्मित इलेक्ट्रॉनों की संख्या अधिकतम (चार) होने के कारण इसे उच्च चक्रण संकुल यौगिक कहते हैं। चार अयुग्मित इलेक्ट्रॉन होने के कारण यह प्रबल अनुचुम्बकीय है।
2. समतल वर्गाकार संकुल यौगिकों में धातु लिगेण्ड आबन्ध
(Metal-Ligand Bonding in Plane Square Complex Compounds)
(i) टेट्रासायनोनिकिलेट (II) आयन, `[Ni(CN)_(4)]^(2-)` -इस जटिल आयन में निकिल, `Ni^(2+)` के रूप में उपस्थित है जिसका इलेक्ट्रॉनिक विन्यास निम्नलिखित है -
`""_(28)Ni=1s^(2), 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(8), 4s^(2)`
`Ni^(2+) = 1s^(2), 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(8)`

जब चार `CN^(-)` आयन `Ni^(2+)` आयन के साथ क्रिया करके `[Ni(CN)_(4)]^(2-)` जटिल आयन बनाते हैं तो प्रबल लिगण्ड `CN^(-)` के द्वारा `Ni^(2+)` आयन के इलेक्ट्रॉन युग्मित हो जाते हैं। इस प्रकार से 3d-कक्षकों में उपस्थित सभी आठ इलेक्ट्रॉन युग्मित हो जाते हैं तथा `dsp^(2)`-संकरण के लिए केवल एक d-कक्षक उपस्थित रहता है जिससे `[Ni(CN)_(4)]^(2-)` जटिल आयन बनता है -
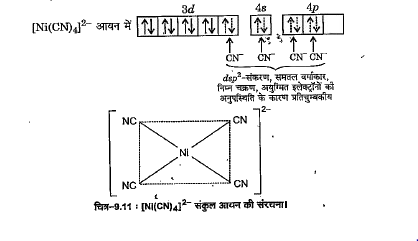
इस संकुल आयन में सभी इलेक्ट्रॉन युग्मित होने के कारण यह प्रतिचुम्बकीय तथा निम्न चक्रण है। `dsp^(2)`-संकरण के कारण यह समतल वर्गाकार है।
(ii) टेट्राऐम्मीनकॉपर (II) आयन, `[Cu(NH_(3))_(4)]^(2+)`- संकुल आयन में कॉपर, `Cu^(2+)` आयन के रूप में उपस्थित है जिसका इलेक्ट्रॉनिक विन्यास निम्नलिखित है -
`""_(29)Cu=1s^(2), 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(10), 4s^(1)`
`Cu^(2+) =1s^(2) , 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(9)`

प्रबल लिगण्ड `NH_(3)` की उपस्थिति में कॉपर dsp-संकरण के कारण समतल वर्गाकार संकुल यौगिक बनाता है। इसमें 3d-कक्षक का एक अयुग्मित इलेक्ट्रॉन 4p कक्षक में उत्तेजित हो जाता है जिससे एक खाली 3d-कक्षक `dsp^(2)` -संकरण के लिए उपलब्ध होता है जैसा कि प्रदर्शित किया गया है -
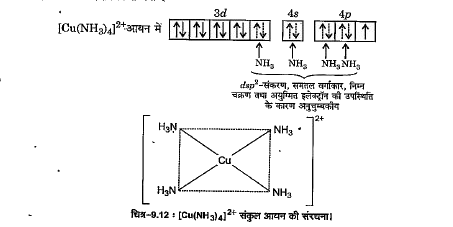
एक अयुग्मित इलेक्ट्रॉन की उपस्थिति के कारण संकुल आयन दुर्बल अनुचुम्बकीय तथा dsp-संकरण के कारण समतल वर्गाकार है।
3. चतुष्फलकीय संकुल यौगिकों में धातु लिगेण्ड आबन्ध
(Metal-Ligand Bonding in Tetragonal Complex Compounds)
(i) टेट्राकार्बोनिलनिकिल (0), `[Ni(CO)_(4)]` - इस संकुल यौगिक में निकिल की ऑक्सीकरण अवस्था शून्य है। निकिल का इलेक्ट्रॉनिक विन्यास निम्नलिखित है -
`""_(28)Ni=1s^(2), 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(8), 4s^(2)`

CO प्रबल लिगेण्ड होने के कारण 4s इलेक्ट्रॉनों को 3d-कक्षकों में उपस्थित इलेक्ट्रॉनों के साथ युग्मित होने के लिए .बाध्य करता है। इस कारण इसमें `sp^(3)`-संकरण तथा चतुष्फलकीय संरचना होती है।

इस संकुल यौगिक में सभी इलेक्ट्रॉन युग्मित होने के कारण यह प्रतिचुम्बकीय तथा निम्न चक्रण है।
(ii) टेट्राक्लोरोनिकिलेट (II) आयन, `[NiCl_(4)]^(2-)` - इस संकुल आयन में निकिल, `Ni^(2+)` आयन के रूप में उपस्थित है जिसका इलेक्ट्रॉनिक विन्यास निम्नलिखित है -
`""_(28)Ni = 1s^(2), 2s^(2), 2p^(6), 3s^(2) 3p^(6) 3d^(8), 4s^(2)`
`Ni^(2+) = 1s^(2), 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(6)3d^(8)`

जब चार `CI^(-)` आयन `Ni^(2+)` आयन के साथ क्रिया करके `[NiCl_(4)]^(2-)`- संकुल आयन बनाते हैं तो इलेक्ट्रॉन युग्मित नहीं होते क्योकि `Cl^(-)` एक दुर्बल लिगेण्ड है। अत: 3d-कक्षकों में से कोई भी कक्षक संकरण के लिए उपलब्ध नहीं होता। इस कारण इसमें `sp^(3)`-संकरण तथा चतुष्फलकीय संरचना होती है -
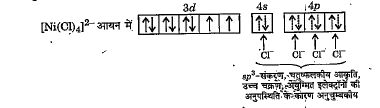
दो अयुग्मित इलेक्ट्रॉनों की उपस्थिति के कारण यह अनुचुम्बकीय है।
यह सिद्धान्त पोलिंग ने सन् 1931 ई० में दिया था। यह संकुल यौगिकों में केन्द्रीय धातु आयन की सामान्य अवस्था में इलेक्ट्रॉनिक संरचना, आबन्ध, ज्यामिति तथा चुम्बकीय गुणों के विषय में जानकारी देता है। संयोजी आबन्ध सिद्धान्त की मुख्य अभिधारणाएँ अनलिखित हैं -
(i) संकुल यौगिकों में केन्द्रीय धातु परमाणु या आयन के पास उचित लिगण्डों के साथ उपसहसंयोजन आबन्ध बनाने के लिए आवश्यकतानुसार खाली कक्षक होते हैं। ये खाली कक्षक केन्द्रीय धातु परमाणु या आयन की उपसहसंयोजन संख्या के बराबर होते हैं।
(ii) केन्द्रीय धातु परमाणु या आयन के ये खाली कक्षक (s, p या d) संकरित होकर समान संख्या में समान ऊर्जा के नए संकरित कक्षक देते हैं। इन संकरित कक्षकों की निश्चित ज्यामिति होती है। संकुल यौगिकों के निर्माण में निम्नलिखित प्रकार के संकरण होते हैं -

(iii) केन्द्रीय धातु परमाणु या आयन के संकरण में भाग लेने वाले.d-कक्षक अन्दर के अर्थात् (n-1)d या बाह्यतम nd कक्षक हो सकते हैं। उदाहरणार्थ-अष्टफलकीय संकरण में भाग लेने वाले कक्षक दो 3d,एक 4s तथा तीन 4p `(d^(2)sp^(3))` अथवा एक 4s, तीन 4p तथा दो 4d `(sp^(3)d^(2))` हो सकते हैं।
(iv) अन्दर वाले d-कक्षकों का प्रयोग करने वाले संकुल यौगिकों में अयुग्मित इलेक्ट्रॉनों की संख्या कम होती है। इन्हें भीतरी कक्षक निम्न चक्रण या चक्रण युग्मित जटिल यौगिक कहते हैं।
प्रबल लिगेण्ड - `NCS^(-) lt Py lt NH_(3)lt e n lt "bipy" lt NO_(2)^(-) lt CN^(-)lt CO`
बाह्य -कक्षकों का प्रयोग करने वाले संकुल यौगिकों में अयुग्मित इलेक्ट्रॉनों की संख्या अधिक होती है। इन्हें बाह्य कक्षक, उच्च चक्रण या चक्रण मुक्त संकुल यौगिक कहते हैं।
दुर्बल लिगेण्ड- `I^(-) lt Br^(-) lt Cl^(-) lt NO_(3)^(-) lt F^(-) lt OH^(-) lt C_(2)H_(5)OH lt C_(2)O_(4)^(2-)lt H_(2)O`
(v) प्रत्येक लिगेण्ड के पास कम-से-कम एक कक्षक होता है जिसके पास एकाकी इलेक्ट्रॉन युग्म होता है।
(vi) लिगेण्डों के केन्द्रीय धातु परमाणु या आयन के निकट आने पर केन्द्रीय धातु परमाणु या आयन के रिक्त संकरित कक्षक लिगेण्ड के भरे हुए कक्षकों के साथ अतिव्यापन करके लिगण्ड व धातु के बीच उपसहसंयोजन आबन्ध बनाते हैं। इन आबन्धों की संख्या केन्द्रीय धातुं परमाणु या आयन के द्वारा उपलब्ध खाली कक्षकों की संख्या पर निर्भर करती है।
(vii) केन्द्रीय धातु परमाणु या आयन के अन्दर वाले कक्षकों में उपस्थित इलेक्ट्रॉन आबन्ध बनाने में भाग नहीं लेते।
(viii) यदि.संकुल यौगिक में एक या अधिक अयुग्मित इलेक्ट्रॉन होते हैं तो यह अनुचुम्बकीय तथा यदि सभी इलेक्ट्रॉन युग्मित होते हैं तो यह प्रतिचुम्बकीय होता है।
(ix) संकुल यौगिकों के निर्माण में हुण्ड के अधिकतम बहुलता नियम का पालन होता है। हुण्ड के नियम के विपरीत इलेक्ट्रॉनों का युग्मन तभी होता है, जबकि लिगेण्ड प्रबल हो।
1. अष्टफलकीय संकुल यौगिकों में धातु लिगेण्ड आबन्ध
(Metal-Legand Bonding in Octahedral Complex Compounds)
ये संकुल यौगिक `d^(2)sp^(3)` या `sp^(3)d^(2)`-संकरण द्वारा प्राप्त होते हैं। `d_(x^(2)-y^(2))` तथा `d_(z^(2))` कक्षक क्योंकि लिगेण्ड के मार्ग में सीधे आते हैं। अतः ये कक्षक इन संकुल यौगिकों के बनने में प्रयुक्त होते हैं। कुछ अष्टफलकीय संकुल यौगिकों के बनने, संरचना, आकार तथा चुम्बकीय गुणों की विवेचना अनलिखित हैं
(i) हेक्साऐम्मीन कोबाल्ट (II) आयन, `[Co(NH_(3))_(6)]^(3+)` - इस जटिल आयन में कोबाल्ट, `Co^(3+)` आयन के रूप में उपस्थित है जिसका इलेक्ट्रॉनिक विन्यास निम्नलिखित है -
`""_(27)Co=1s^(2), 2s^(2) 2p^(6), 3s^(2) 3d^(7), 4s^(2)`
`Co^(3+) = 1s^(2), 2s^(2)2p^(6), 3s^(2) 3p^(6) 3d^(6)`
`Co^(3+)` आयन में

जब छह `NH_(3)` के अणु `Co^(3+)` आयन के साथ क्रिया करके `[Co(NH_(3))_(6)]^(3+)` संकुल आयन बनाते हैं तो प्रबल लिगेण्ड `NH_(3)` के द्वारा `Co^(3+)` आयन के इलेक्ट्रॉन हुण्ड के नियम के विपरीत युग्मित हो जाते हैं तथा संकरण के छह खाली कक्षक `(d^(2)sp^(3))` उपलब्ध होते हैं, परिणामस्वरूप `Co^(3+)` आयन में `d^(2)sp^(3)` संकरण होता है, जिससे `[Co(NH_(3))_(6)]^(3+)` संकुल आयन के बनने के लिए समान ऊर्जा के छह संकरित कक्षक प्राप्त होते हैं -

अन्दर के d-कक्षकों के बन्ध बनाने में प्रयुक्त होने के कारण इसे भीतरी कक्षक संकुल यौगिक कहते हैं। अयुग्मित इलेक्ट्रॉन न होने के कारण यह प्रतिचुम्बकीय है।
`[Co(NO_(2))_(6)]^(3-), [Co(CN)_(6)]^(3-)`- संकुल आयनों की संरचनाएँ `[Co(NH_(3))_(6)]^(3+)` आयन जैसी होती हैं।
(ii) हेक्साऐक्यो आयरन (II) आयन, `[Fe(H_(2)O)_(6)]^(2+)` - इस संकुल आयन में आयरन, `Fe^(2+)` के रूप में उपस्थित है जिसका इलेक्ट्रॉनिक विन्यास निम्नलिखित है -
`""_(26)Fe=1s^(2), 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(6), 4s^(2)`
`Fe^(2+) =1s^(2) , 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(6)`

जब छह जल के अणु `Fe^(2+)` आयन के साथ क्रिया करके `[Fe(H_(2)O)_(6)]^(2+)` संकुल आयन बनाते हैं तो इलेक्ट्रॉन युग्मित नहीं होते क्योंकि `H_(2)O` एक दुर्बल लिगेण्ड है। अत: 3d-कक्षकों में से कोई भी कक्षक संकरण के लिए उपलब्ध नहीं होता। इस स्थिति में दो खाली 4d-कक्षक संकरण में भाग लेते हैं, परिणामस्वरूप `Fe^(2+)` आयन में `sp^(3)d^(2)` - संकरण होता है जिससे `[Fe(H_(2)O)_(6)]^(2+)` आयन के बनने के लिए समान ऊर्जा के छह संकरित कक्षक प्राप्त होते हैं -

बाह्यतम कोश के d-कक्षकों के आबन्ध बनाने में प्रयुक्त होने के कारण इसे बाह्यतम कक्षक संकुल यौगिक कहते हैं। अयुग्मित इलेक्ट्रॉनों की संख्या अधिकतम (चार) होने के कारण इसे उच्च चक्रण संकुल यौगिक कहते हैं। चार अयुग्मित इलेक्ट्रॉन होने के कारण यह प्रबल अनुचुम्बकीय है।
2. समतल वर्गाकार संकुल यौगिकों में धातु लिगेण्ड आबन्ध
(Metal-Ligand Bonding in Plane Square Complex Compounds)
(i) टेट्रासायनोनिकिलेट (II) आयन, `[Ni(CN)_(4)]^(2-)` -इस जटिल आयन में निकिल, `Ni^(2+)` के रूप में उपस्थित है जिसका इलेक्ट्रॉनिक विन्यास निम्नलिखित है -
`""_(28)Ni=1s^(2), 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(8), 4s^(2)`
`Ni^(2+) = 1s^(2), 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(8)`

जब चार `CN^(-)` आयन `Ni^(2+)` आयन के साथ क्रिया करके `[Ni(CN)_(4)]^(2-)` जटिल आयन बनाते हैं तो प्रबल लिगण्ड `CN^(-)` के द्वारा `Ni^(2+)` आयन के इलेक्ट्रॉन युग्मित हो जाते हैं। इस प्रकार से 3d-कक्षकों में उपस्थित सभी आठ इलेक्ट्रॉन युग्मित हो जाते हैं तथा `dsp^(2)`-संकरण के लिए केवल एक d-कक्षक उपस्थित रहता है जिससे `[Ni(CN)_(4)]^(2-)` जटिल आयन बनता है -

इस संकुल आयन में सभी इलेक्ट्रॉन युग्मित होने के कारण यह प्रतिचुम्बकीय तथा निम्न चक्रण है। `dsp^(2)`-संकरण के कारण यह समतल वर्गाकार है।
(ii) टेट्राऐम्मीनकॉपर (II) आयन, `[Cu(NH_(3))_(4)]^(2+)`- संकुल आयन में कॉपर, `Cu^(2+)` आयन के रूप में उपस्थित है जिसका इलेक्ट्रॉनिक विन्यास निम्नलिखित है -
`""_(29)Cu=1s^(2), 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(10), 4s^(1)`
`Cu^(2+) =1s^(2) , 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(9)`

प्रबल लिगण्ड `NH_(3)` की उपस्थिति में कॉपर dsp-संकरण के कारण समतल वर्गाकार संकुल यौगिक बनाता है। इसमें 3d-कक्षक का एक अयुग्मित इलेक्ट्रॉन 4p कक्षक में उत्तेजित हो जाता है जिससे एक खाली 3d-कक्षक `dsp^(2)` -संकरण के लिए उपलब्ध होता है जैसा कि प्रदर्शित किया गया है -

एक अयुग्मित इलेक्ट्रॉन की उपस्थिति के कारण संकुल आयन दुर्बल अनुचुम्बकीय तथा dsp-संकरण के कारण समतल वर्गाकार है।
3. चतुष्फलकीय संकुल यौगिकों में धातु लिगेण्ड आबन्ध
(Metal-Ligand Bonding in Tetragonal Complex Compounds)
(i) टेट्राकार्बोनिलनिकिल (0), `[Ni(CO)_(4)]` - इस संकुल यौगिक में निकिल की ऑक्सीकरण अवस्था शून्य है। निकिल का इलेक्ट्रॉनिक विन्यास निम्नलिखित है -
`""_(28)Ni=1s^(2), 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(8), 4s^(2)`

CO प्रबल लिगेण्ड होने के कारण 4s इलेक्ट्रॉनों को 3d-कक्षकों में उपस्थित इलेक्ट्रॉनों के साथ युग्मित होने के लिए .बाध्य करता है। इस कारण इसमें `sp^(3)`-संकरण तथा चतुष्फलकीय संरचना होती है।

इस संकुल यौगिक में सभी इलेक्ट्रॉन युग्मित होने के कारण यह प्रतिचुम्बकीय तथा निम्न चक्रण है।
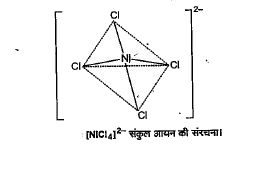
(ii) टेट्राक्लोरोनिकिलेट (II) आयन, `[NiCl_(4)]^(2-)` - इस संकुल आयन में निकिल, `Ni^(2+)` आयन के रूप में उपस्थित है जिसका इलेक्ट्रॉनिक विन्यास निम्नलिखित है -
`""_(28)Ni = 1s^(2), 2s^(2), 2p^(6), 3s^(2) 3p^(6) 3d^(8), 4s^(2)`
`Ni^(2+) = 1s^(2), 2s^(2) 2p^(6), 3s^(2) 3p^(6) 3d^(6)3d^(8)`

जब चार `CI^(-)` आयन `Ni^(2+)` आयन के साथ क्रिया करके `[NiCl_(4)]^(2-)`- संकुल आयन बनाते हैं तो इलेक्ट्रॉन युग्मित नहीं होते क्योकि `Cl^(-)` एक दुर्बल लिगेण्ड है। अत: 3d-कक्षकों में से कोई भी कक्षक संकरण के लिए उपलब्ध नहीं होता। इस कारण इसमें `sp^(3)`-संकरण तथा चतुष्फलकीय संरचना होती है -

दो अयुग्मित इलेक्ट्रॉनों की उपस्थिति के कारण यह अनुचुम्बकीय है।

Recommended Questions
- अष्टफलकीय संकरों के निर्माण की व्याख्या VBT किस प्रकार करती है?
Text Solution
|
- द्विघात बहुपद ax^(2)+bx+c के आलेख की आकृति किस प्रकार की प्राप्त होती ...
Text Solution
|
- मृदा में पोशकों की पुनरावृति किस प्रकार होती है
Text Solution
|
- दूध से दही का बनना किस प्रकार के परिवर्तन की श्रेणी में आता है?
Text Solution
|
- फीचर किस प्रकार की विधा मानी जाती है?
Text Solution
|
- रजनी किस प्रकार की नारी है?
Text Solution
|
- मीरा कृष्ण की उपासना किस रूप में करती है?
Text Solution
|
- फीचर किस प्रकार की विधा मानी जाती है ?
Text Solution
|
- सरल लोलक की गति किस प्रकार की गति है
Text Solution
|